

Rappel
Comment trouve-t-on la masse moléculaire d’une substance ?
Motivation
Comment appelle-t-on la grandeur symbolisée par n en chimie ?
Annonce du sujet
Qu'allons-nous étudier aujourd'hui?
Analyse
Qu'est-ce que la mole?
Qu’est-ce que l’équivalent chimique ?
Par qui fut découvert le nombre d’Avogadro ?
On trouve la masse moléculaire d'une substance en faisant la somme algébrique des masses atomiques relatives des atomes qui constituent la molécule.
La grandeur symbolisée par n en chimie s’appelle nombre des moles.
Aujourd'hui, nous allons étudier la mole et l'équivalent chimique.
La Mole
La mole est la quantité de la matière renfermant 6,02.1023 particules (atomes, molécules, ions ou électrons).
En effet,NA=6,02.1023 particules par mole (particules/mol).
Ce nombre fut déterminé par le chimiste et physicien français Jean Baptiste Perrin. Le terme mole peut être utilisé comme unité de quantité de matière. Dans ce cas, on fait tomber le "e" terminal du terme mole.
La masse molaire
C’est la masse d’une mole ou d’une substance. Elle s’exprime en g/mol
Mm= Ar g/mol ou Mrg/mol
Ar : Masse atomique relative en u.m.a.
Mr : Masse moléculaire relative en u.m.a.
L'équivalent chimique( E)
L’équivalent Chimique(E) est la quantité en g, capable de libérer ou de capter une mole d’électron suivant la rx chimique considérée.
En effet:
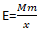
E : équivalent en (g/éq.)
X : nombre des particules échangées en (éq/mol)
Le nombre d'Avogadro fut découvert par le chimiste et physicien français Jean Baptiste Perrin.
