

a) Révision: Pour neutraliser complétement 100ml d'une solution de HCL, il faut 2,16 g de corbonate de collium par la nosmalité de l'acide était: 1. 4,32N, 2. 1,08N, 3. 0,432N , 4. 0,216N, 5. 0,108N.
b) Motivation: Quelle est la méthode qui est basée sur le titrage en utilisant le pouvoir axglent?
c) Annonce du sujet
Qu'est-ce que nous allons étudier aujourd'hui?
Exemple: on dissent 0,5g d'un échantillon de fer impur dans 35ml d'acide sulfurique pour former le Fe2+. On utilise 50ml d'une solution KmnO4 , 0,02M pour voir la pureté de l'échantillon.
Quels sont les principes d'iooloretrie et iodimetrice ?
Exemple 2: on troite 0,2g de pyrolusite (diolyde de manganèse ) par 25 ml d'une solution de Hcl à 37% et on recueille le chlore qui se degage dans une solution de KI à 2%. on titre l'iode liberé par la réaction au moyen d'une solution de thiosulfate do sodium 0,1N . On utilise à cet effet 38,2ml.Quel
SYNTHESE
Cfr analyse
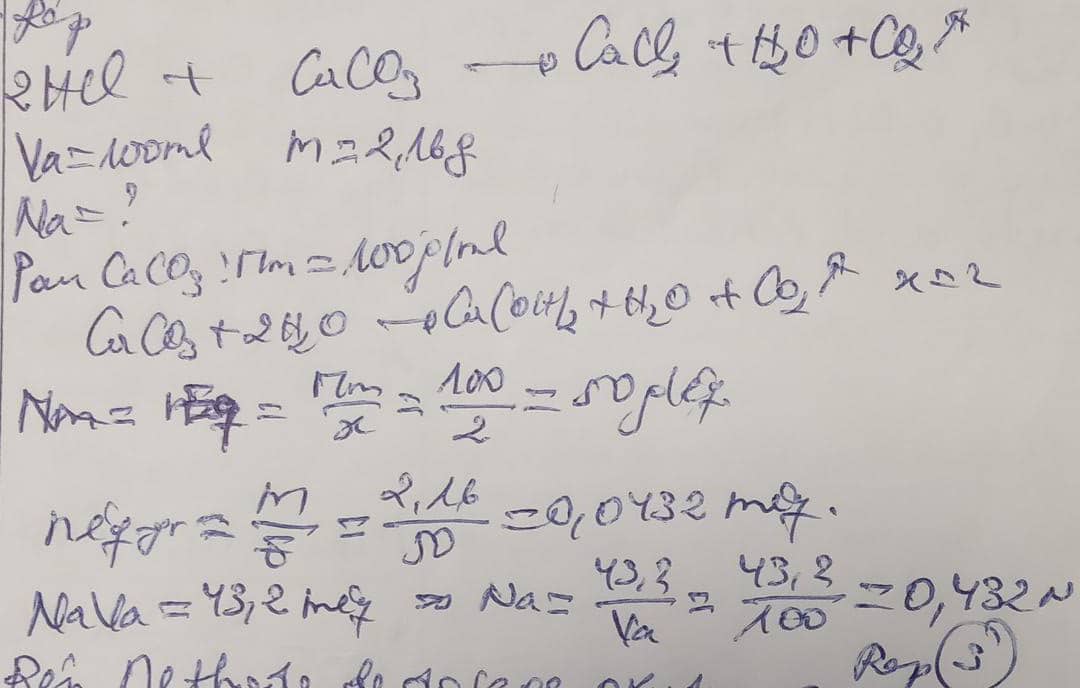
Méthode de dosage oxydo-reduction.
Aujourd'hui nous allons parlé de dosage oxydo-reduction
4. DOSAGE OXYDO-REDUCTION
1. Manganimétrie ou manganamètrie :
c'est une méthode qui est basée sur le titrage en atilisant le pouvoir axydoant de l'ion Mn O4.
a) Avantages et inconvéniens
#Avantage: le Permanganation sert lui-même d'indicateur de fin de titrage
MnO4--------> Mn2+ violet incolore
Le permangamate est un axydant fort, il permet de doser presque tous les reducteurs et sauvent en milieu acide.
# Inconvienent : - le permanganate est exposé à une décomposition en fonction du temps par ce qu'il est oxydent fert.
MnO1 -------> MnO2
- certains acides tels que Hcl et HNO3 ne parvent pas être utilisé.
- le Hcl étant reducteur, il peut réagin avec le KMnO4 en dégageant le cl2.
- HNO3 étant oxydant, il peut concurencer le KMnO4 pour réagir avec acide le reducteur .
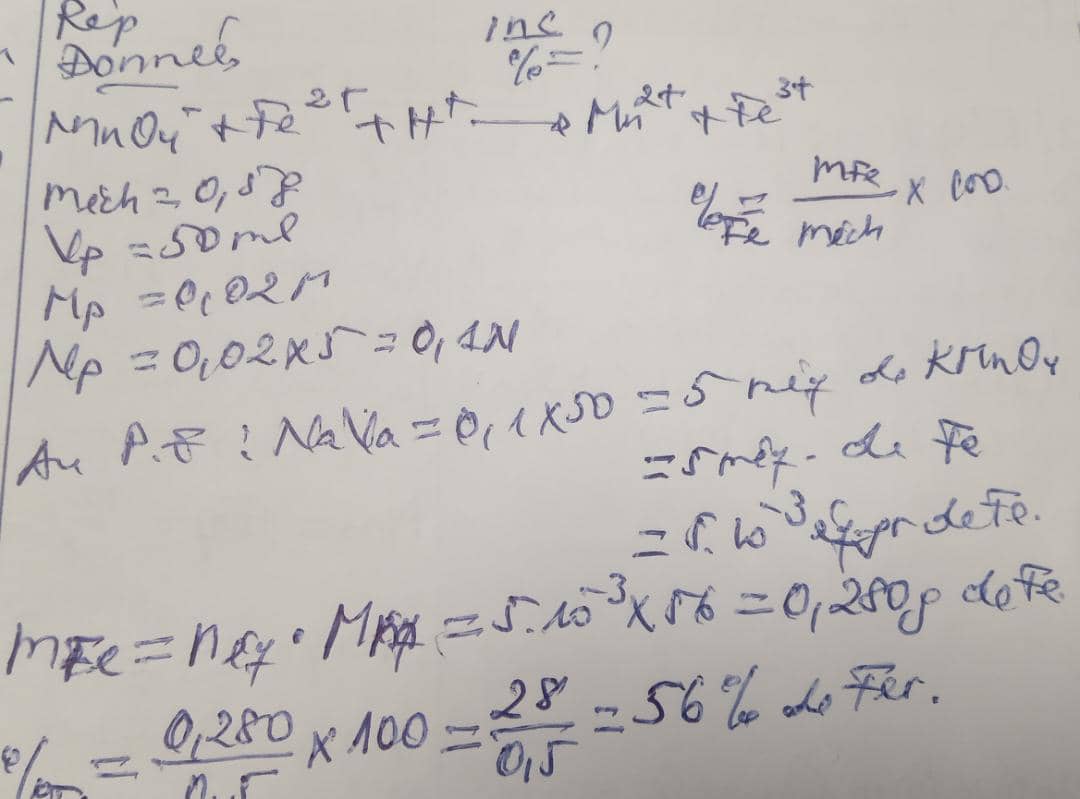
2.IODOMETRIE OU IODIMETRIE
1.Définition : l'iodometrie et iodimetrie sont cas de titrage qui consiste à doser un oxyolant au reducteur par le couple
F2/ I (Eo = +0,54V). I2 + 2e ----> <------ 2I
2. Principe:
* l'iodometrie consiste à doser un oxydant par la molécule de diode ( I2) en exces.
* l'iodimetrie consiste a doser un reducteur par l'ion iodune(I')
3. Preparation de l'diode (I2) et NaS2O3
a) Preparation de diode (I2)
Le diode est un solide . le preparation des solution acqueuse se fait par pesée. Mais le diode ne se dissent dans l'eau qu'en presence d'ions iodure.
la solution d'ions iodure à utiliser est une solution à 2% de KI
Eqgr = 254/2 = 127 gleq.
