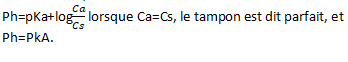Rappel
Qu’est-ce qu’un mélange tampon ?
Annonce du sujet
Qu'allons-nous étudier aujourd'hui?
Analyse
Qu’est-ce qui fait déplacer l’équilibre ?
Quelle conséquence lorsque Ca=Cs ?
Un mélange tampon est celui , dont le PH ne varie pas lorsqu’on y ajoute certaines particules (H+,OH-).
Aujourd’hui, nous allons étudier le PH des solutions tampon.
Cas d’une solution aqueuse de CH3COOH/CH3COONa en solution on a : CH3COOH+⇌H++CH3COO-
CH3COOH⇌CH3COO-+Na+
L’addition de l’ion CH3COO- provenant du sel dans la solution de CH3COOH fait déplacer l’équilibre dans le sens par effets d’ion commun inverse de telle manière que l’on peut écrire :
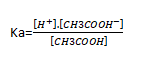
Or [CH3COOH-]=CS+[H+] et [CH3COOH]=Ca-[H+]
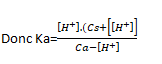
En résolvant cette équation du second degré, on trouve :
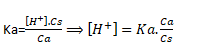
En introduisant l’inverse du log dans ces 2 membres de cette relation, on a :
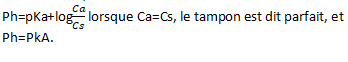
Conséquence lorsque Ca=Cs