

Rappel
Quelles sont les formules pour calculer le PH d’une base forte et faible, d’un mélange tampon, acide et base ?
Motivation
Quand est-ce qu’on peut utiliser toutes ces formules ?
Annonce du sujet
Qu'allons-nous voir aujourd'hui?
Analyse
Calculez le PH de KOH 0,02N.
Calculez le PH des solutions tampons suivantes constituées de :
0,2N NH4OH et 0,45N NH4NO3
PKb=4.7
Quel est le PH d’une solution 10-2molaire en NH4Cl et 10-1molaire
(NH4OH) Kb=1,8.10-5
Comment sommes-nous parvenus à trouver les réponses à tous ces PH ?
Les formules pour calculer le PH d’une base forte et faible, d’un mélange tampon, acide et base sont :
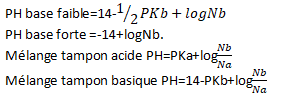
Les formules ci-haut peuvent être utilisées lors des exercices.
Aujourd'hui, nous allons voir les exercices sur le calcul de PH des solutions.
Le PH de KOH 0,02N
Solution:
KOH est une base forte le PH=14+logNb
PH=14+log0,02
=14+log2.10-2
=14+log2+log10-2
=14+0,30+(-2).1
=14+0,30-2.1=12,3
le PH des solutions tampons suivantes constituées de :
0,2N NH4OH,
0,45N NH4NO3,
PKb=4.7
voici la solution :
Comme il s’agit d’un mélange tampon basique le PH=14-PKb+log(Nb / Na)
PH=14-4,7+log(0.20 / 0,45) =14-4,7log0,20-log0,42
=14-4,7+1,30+(-2) -1.65+(-é).1
=14-4,7+1,30+2-1,65+2
=14-4,7+3,30-3,65
=9,3+(-0,35) =8,95
le PH d’une solution 10-2molaire en NH4Cl et 10-1molaire
(NH4OH) Kb=1,8.10-5
Est le suivant:
Trouvons PH= ? et PKb= ?
Formules : PH=14-PKb+log(Nb / Na) et PKb=-logKb
Calculons : PKb=-log1,8. 10-5
= -log18. 10-6
=-log18 +log10-6
=-1,25+(-6).1
=-1,25-6.1
=4,85.
PH=14-4,75+log10-110-2
=14-4,75+(-1)log-(-2)log10
=14-4,75+(-1).1-(-2).1
=9.25+(-3)
=6.25
Nous sommes parvenus à trouver les réponses à tous ces PH en appliquant les formules.