

Rappel
11,7 d'acétylène occupent un volume de 10/ (10-6 m3) à 50°C quelle est la pression du gaz?
Rappel
11,7 d'acétylène occupent un volume de 10/ (10-6 m3) à 50°C quelle est la pression du gaz?

V = 10 I = 10-6 m3
T = 50 + 273,15 = 313,150 K
R = 8, 314 j
10-6 P = 0, 45. 8, 314 et 323, 15
P = 120900Pa
Motivation
Un gaz qui va en dehors des lois citées s'appelle?
Motivation
Un gaz qui va en dehors des lois citées s'appelle le gaz réel.
Annonce du Sujet
Qu'allons-nous étudier aujourd'hui?
Annonce du Sujet
Aujourd'hui nous allons étudier les gaz réels.
Analyse
Par quoi se distingue les lois étudiées et les gaz réels?
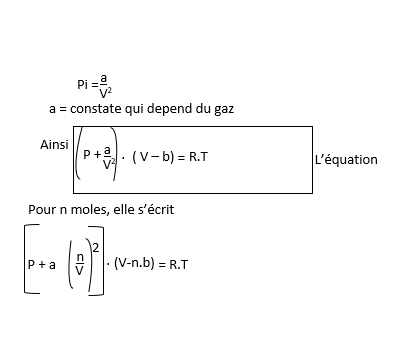
Quelle est l'équation de Van Der waals?
Analyse
Les lois réelles se distinguent des gaz parfaits et d'autres lois de gaz par les points ci-après :
La pression trop faible;
Les interactions moléculaires non négligeables;
Le volume des molécules du gaz non nul.
Cependant, tenant compte des points pré-cités Van Der waals apporte des correctifs à l'équation d'état des gaz réels :
Qu'est-ce que nous venons d'étudier?
Nous venons d'étudier les gaz réels.
