

a)Révision: A 100 cm3 d'acide nitriqe 9.10-2N on ajoute 200cm3 de soude coutique 3.10-1N. le pH de la solution vaut:
1. 13,22; 2. 13,10; 3. 13,23; 4. 13,03; 5.13,21.
b) Motivation:
Comment peut-on déterminer le pH d'une solution résultante en fonction de volume?
c) Annonce du sujet:
Qu'est-ce que nous allons étudier aujourd'hui?
II. Analyse:
Exemple:
1) Tracez la courbe de neutralisation de 10ml de la solution Hcl 1N à la quelle on ajouté: 0;2;5;8;9,99;10,01;10,1;12;15;18; 20 ml de la solution de NaOH 1N.
2) A 20 ml d'une solution de H2SO4 0,2M, on ajoute 30 ml d'une solution de KOH 0,3N.
a) Quel est le pH de la solution obtenue?
b) Quelle masse en g de sel formé?
3) On neutralise une solution 0,1N de Hcl par une solution 0,1N de NaOH. Calculez le zone du saut de pH.
III. SYNTHESE
Cfr Analyse

Aujourd'hui nous allons parlé de la courbe de neutralisation
3.3. COURBE DE NEUTRALISATION
Lorsqu'on dose un acide par une base ou une base par un acide, il est possible de determiner le pH de la solution resultante en fonction du volume de reactif à ajouté ph=f(v)
1) courbes de neutralisation d'un acide fort par une base forte

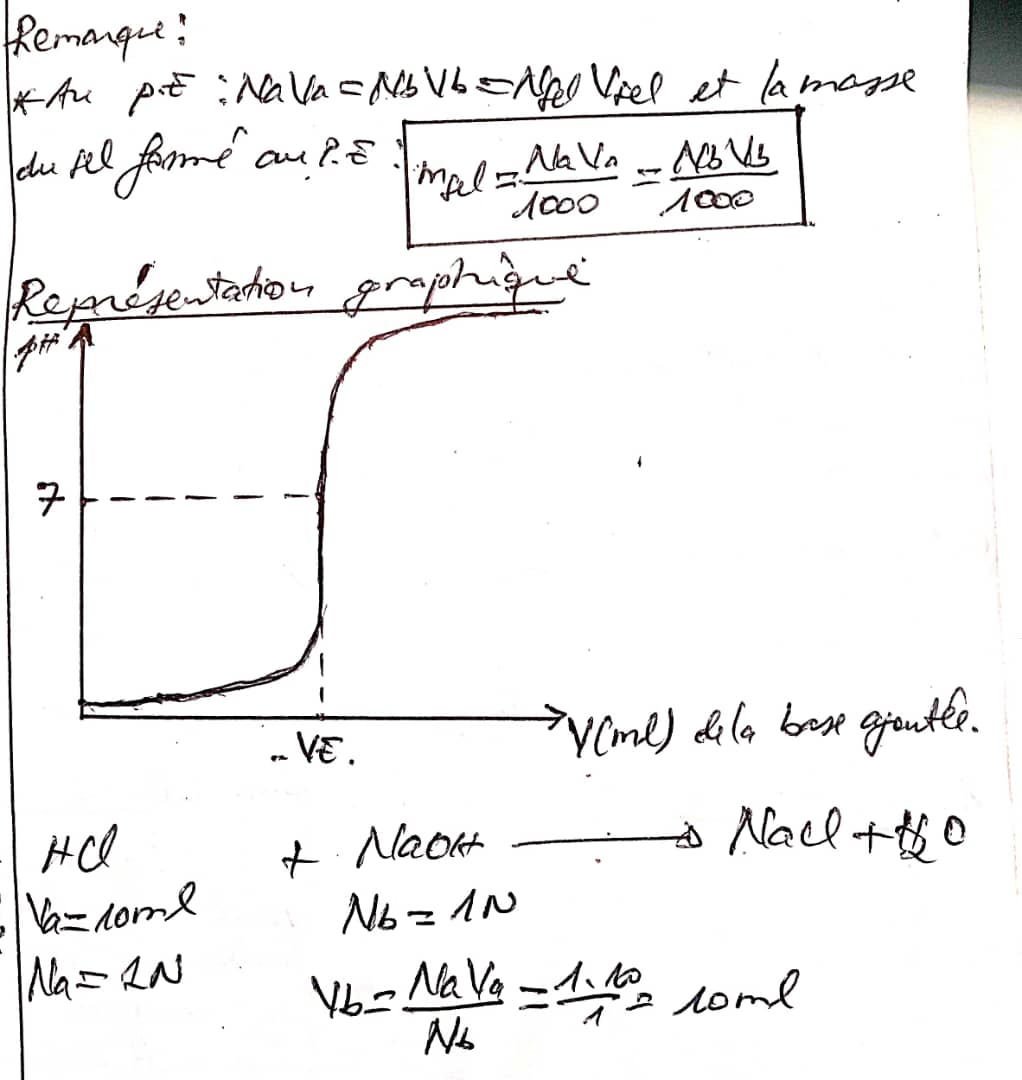
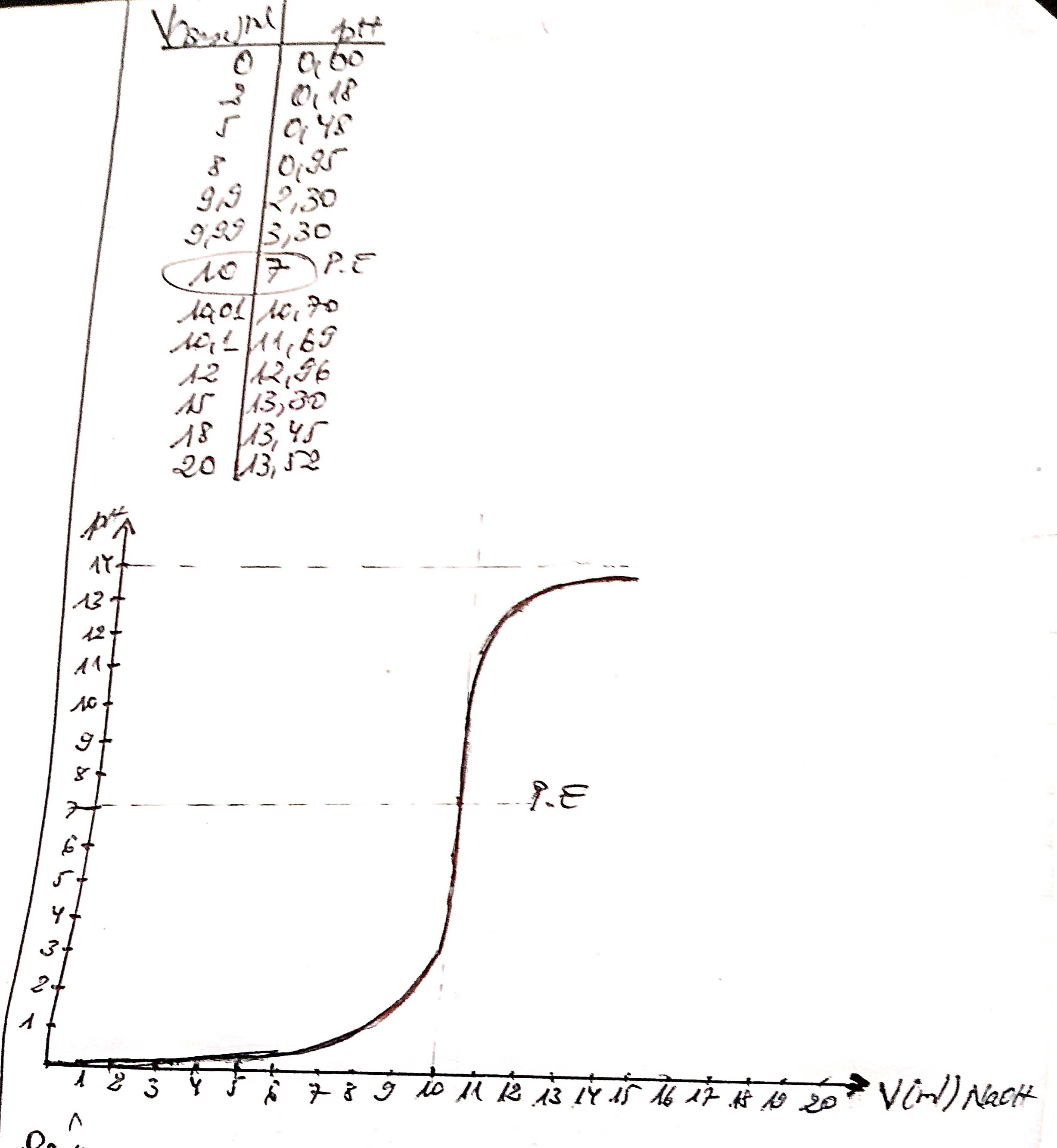

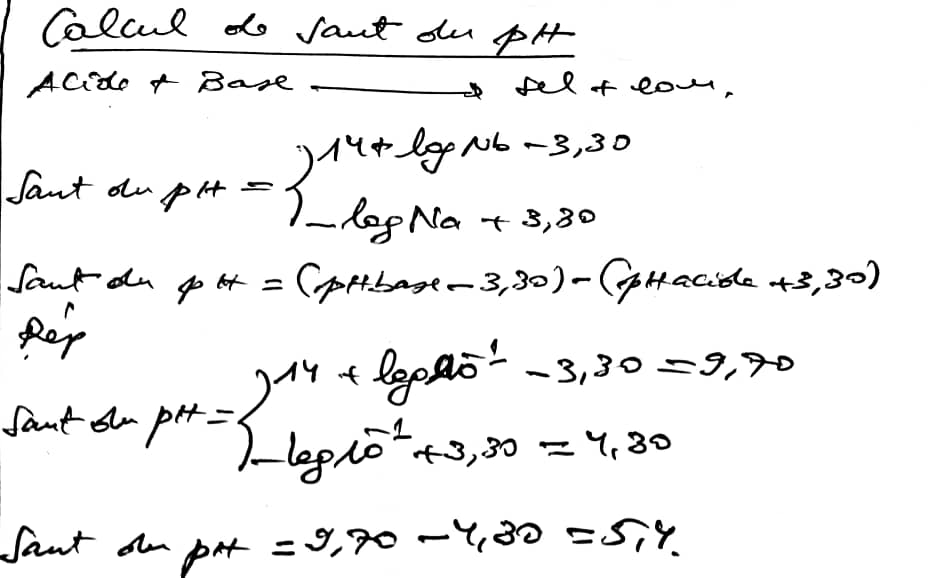
-Pour neutraliser un acide fort par une base forte, on place l'acide dans le becher et la base dans une burette.
le soude pH est calculer par la relation suivante: seut du ph= 14+logNb-3,30. { -logNa + 3,30.