

a) Révision:
Qu'entendez-vous par : 1) Une Oxydation?; 2) une réduction?
b) Motivation: Comment appel-t-on deux phenomèns simultanés et inverse ?
c) Annonce du sujet:
Nous allons étudier quoi aujourd'hui ?
II. Analyse
Exemples: Equilibrez les demi-équation redox suivants:
2) Equilibrez les demi-équation suivant
3) Chercher les coéfficients de la réaction suivante : KBr + KMnO4 + H2SO ---> Br2 + nrSO4 + K2SO4 + H2O
a) 10|2|8|| 5| 2|2|6|8
b) 5|1|4||5|1|3|4
c)5|1|4||5|1|3|4
d) 6|1|4|6||1|3|4
e) 5|2|8||5|2|6|8.
3. ETABLISSEMENT DES DEMI-EQUATIONS REDOX
3.1. Demi-équation redox relative à une oxydation

Règles: 1.Equilibrez les atomes compendant dans les deux membres de l'équation.
2.S'il manque des atomes d'oxygène dans le 2è membre, on ajoute dans le 1er des ions H+ si la réaction se passe dans le milieu acide et OH- Si la réaction se passe dans le milieu basique
3.Equilibrez les charges dans les 2 membres en ajoutant le nombre d'élections nécessaires dans le 2ème membres
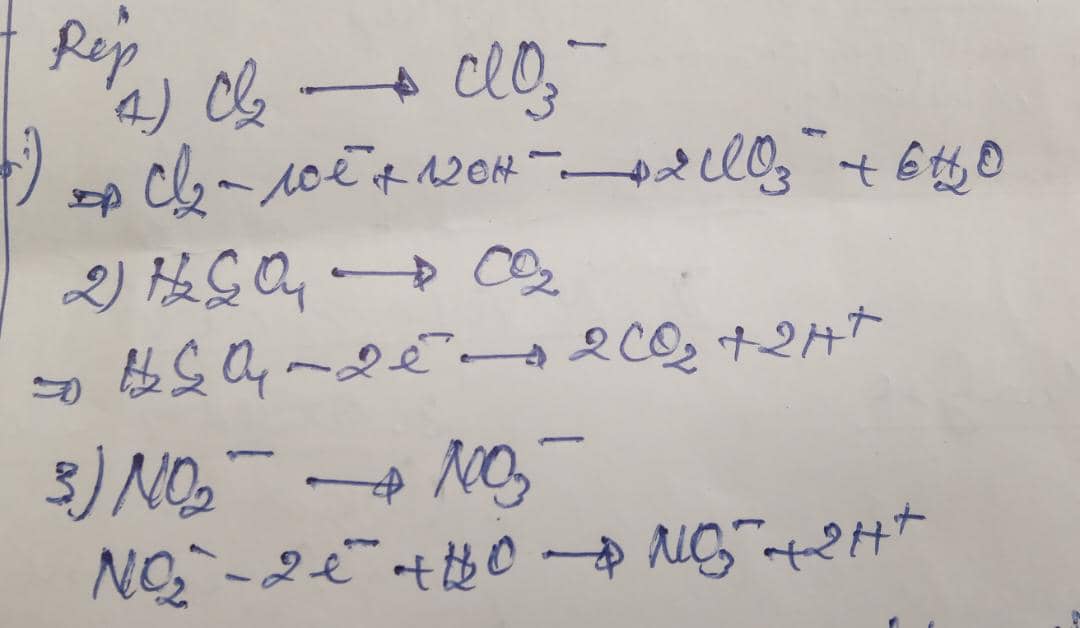
3.2.Demi-équation redox relative à une réduction
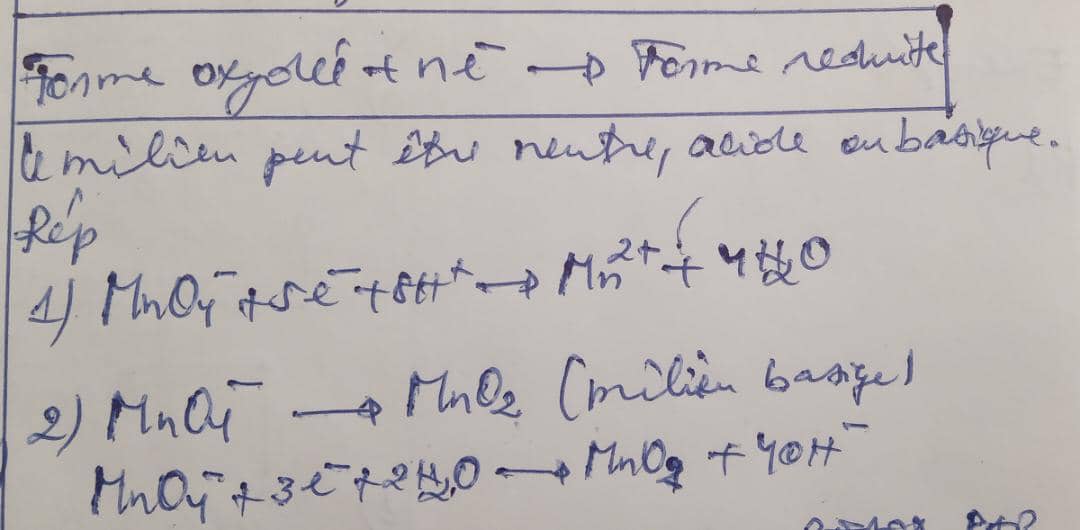
4.EQUILIBRAGE DES EQUATION REDOX PAR METHODE DE DEMI-EQUATION REDOX
Règles:
1.determinez l'oxydant et le réduction parle calcul rapide des EO, déterminer ainsi le couple oxydation et réducteur.
2. Etablissez les demi-équation redox relative à l'oxydation et à la réduction.
3.Equilibrez le nombre d'électrons échangés par le couple oxydant et réduction en calculant le PP cm des nombres d'élections perdus par le reducteur et gagnés par l'oxydant.
4. On obtient ainsi les coefficients pour les deux demi-équations redox.
5. Additionner membre par membre le deux demi équation redox en simple fant si besoin les ions communs aux deux membres
6. on obtient l'équation ionique globale.
7. Vérifiez les charge car le nombre de charge à gauche de l'équation doit être égal au nombre de charge à droite.
8. Partez les coefficients dans l'équation moléculaire

