

Rappel
Citez quelques électrolytes forts ? ET donnez-en quelques exemples.
Citez les quelques exemples des électrolystes faibles
Motivation
Qu'est-ce que le propriété moise a retiré au mont " SINAI?
Donnez le mot synomimé à commendement
Analyse
Quelles sont les lois quantitatives de l'électrolyse?
Qu'est-ce que la quantité du courant?
Par quoi est symbolisé la masse atomique , ou peut-on en trouver
Qu'est-ce que la valence gramme?
Qu'est-ce qu'un Faraday?
Quelle est la masse du métal à la cathode ?
Synthèse
Qu'est-ce la quantité du courant?
Quelle est la valence gramme? de Na dans NaOH?
Tous les acides forts, toutes les bases fortes , les sels de (MR).
Ex: HNO3? H2SO4,NaOH, KOH; NaCl; K2(SO4)
Tous les acides faibles, toutes les bases faibles, les sels de mr. ex: HNO2, Fe(OH)3, Kbr..
Au mont (S4 nai) le propriété moise avait sert le 10 commandement de Dieu.
Le mont commandement son synomine c'est loi règlement.
Aujourd'hui nous allons étudie les lois pas de Dieu, mais plutôt, les lois quantitative de l'électrolyse.
1ere loi: La quantité d'électricité qui passe dans l'électrolyte égale aux produit de l'intensité du courant électrique pas la durée de l'électrolyte.
Q=I.t; Q= qté du courant en coulomb (c); I= intensité du courant en Ampère (A); t= temps (s).
La même quantité de l'électricité livère la même nombre de valence - gramme.
La valence - gramme est le quotient de la masse atomique de cette élément par sa valence : A/n
2eme loi: Il faut une quantité de l'électricité de 96500c. Pour libèrer une valence - gramme.
cette quantité de l'électricité s'appelle FARADAY 1F= 96500c
la masse du métal déposée à la cathode se calcule par la relation suivante :
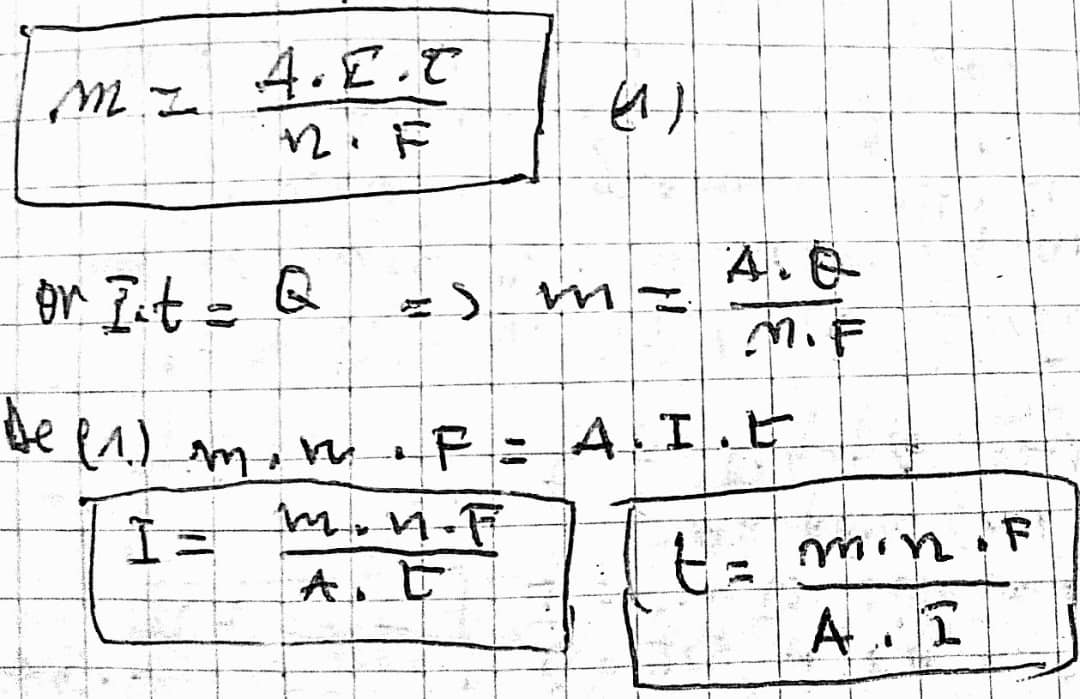
La quantité du courant se calcule par la relation suivante : Q=I.t
NaOH---> Na+ + OH- n=1
A=32g A/n= 23/1=23g